Com realitzar dilucions en sèrie
Autora:
Roger Morrison
Data De La Creació:
19 Setembre 2021
Data D’Actualització:
1 Ser Possible 2024
Content
- etapes
- Mètode 1 Realitzeu una dilució senzilla
- Mètode 2 Calcula el factor i la concentració de dilució final
En química, una dilució consisteix a reduir la concentració d’una solució determinada. Una dilució en sèrie és simplement una dilució repetida d’una solució original per amplificar ràpidament el factor de dilució. Aquest tipus de dilució es realitza sovint durant experiments que requereixen solucions altament diluïdes i una gran precisió, com per exemple aquelles que impliquen corbes de concentració a escala de registre o aquelles que permeten calcular la densitat de bacteris en determinats medis. Molt sovint es fan en bioquímica, microbiologia, farmacologia o química.
etapes
Mètode 1 Realitzeu una dilució senzilla
-

Determineu el líquid (o diluent) diluït adequat. L’elecció del diluent és molt important i depèn de la solució que vulgueu diluir. El diluent és sovint aigua destil·lada, però no és sistemàtic. Així, amb una solució que conté bacteris o cèl·lules, s'utilitza un medi de cultiu. Per a la dilució en sèrie, s'utilitza el mateix diluent a tots els tubs.- Si no esteu segurs de quin diluient utilitzar, sol·liciteu ajuda d’una persona competent o busqueu a Internet el que ha de fer la gent per a una experiència similar.
-
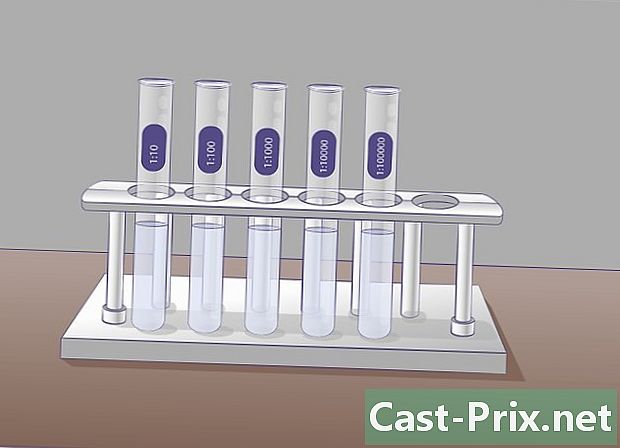
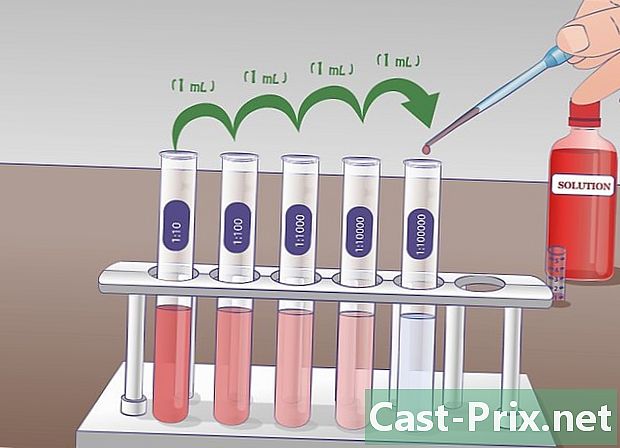
Prepareu diversos tubs d’assaig que continguin 9 ml d’un líquid diluït. Aquests tubs d’assaig s’utilitzaran per fer dilucions successives. El principi és simple, prendràs una mostra de la solució inicial i la transferireu al tub següent, i després agafareu una mostra d’aquest tub per posar-la al següent, etc.- Abans d’iniciar les dilucions, és recomanable identificar amb antelació les provetes per evitar més confusions.
- A cada tub, tindreu una concentració deu inferior a l’anterior. El primer tub contindrà una solució diluïda al desè, segon, centèsim, tercer, milèssim, etc. Determineu amb antelació el nombre de dilucions per evitar fer més tubs dels necessaris i diluir els residus innecessàriament.
-
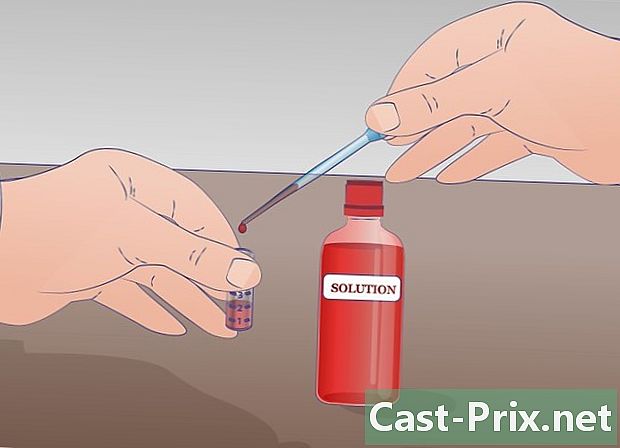
Prepareu una proveta amb la vostra solució mare. Poseu almenys 2 ml. La quantitat mínima de solució d'estoc per a la dilució en sèrie és d'un mil·lilitre. Deixeu 2 ml per a una possible segona dilució. Aquest tub de solució mare, el podeu marcar com a "SM".- Abans d’iniciar una dilució en sèrie, barregeu bé la solució inicial.
-
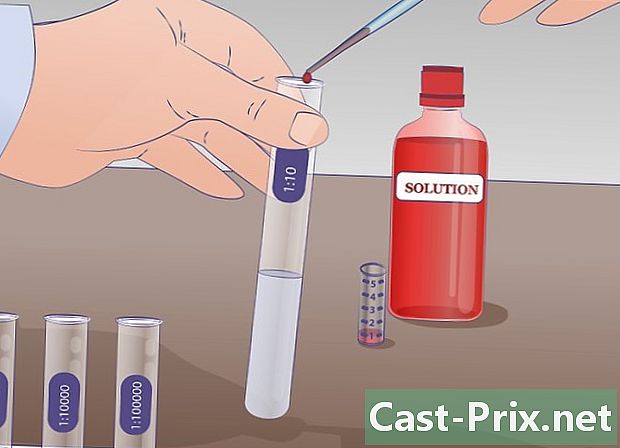
Feu la primera dilució. Pipeteu 1 ml de la solució en estoc al tub d'assaig etiquetat com a "SM" i transferiu aquesta quantitat al tub d'assaig etiquetat. 1/10 que ja conté 9 ml de líquid de dilució. Barregeu per obtenir una solució homogènia. En aquest tub, ara hi ha 10 ml de solució: 1 ml de solució borsària i 9 ml de líquid de dilució. Aquesta nova solució és deu vegades menys concentrada que l’anterior. -
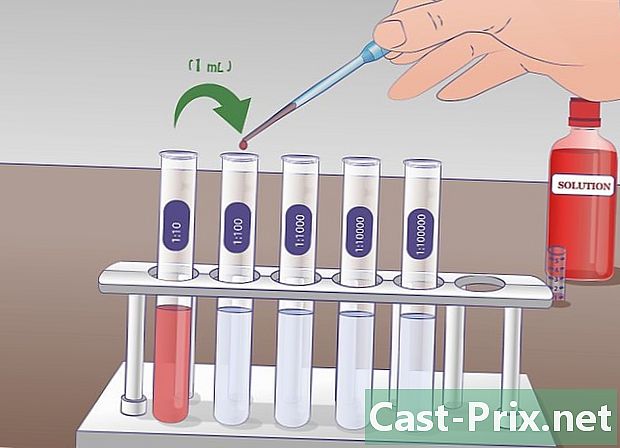
Realitzeu la segona dilució. En la segona dilució en sèrie, traureu 1 ml de solució de tub etiquetada 1/10 i ho abocareu al tub 1/100 que ja conté 9 ml de líquid de dilució. El tub 1/10 hauran estat ben barrejats abans del mostreig. Un cop feta la transferència, barregeu bé el tub 1/100. La solució del tub marcat 1/10 és 10 vegades més concentrada que la del tub etiquetat 1/100. -

Repetiu aquesta manipulació si cal. Aquest procediment es pot repetir tantes vegades com es desitgi fins que s’aconsegueixi la dilució desitjada. Per a un experiment amb corbes de concentració, podeu obtenir una sèrie de solucions amb dilucions a la unitat, la desena (1/10), la centèsima (1/100) o la mil·lèsima (1/1000).
Mètode 2 Calcula el factor i la concentració de dilució final
-

Calculeu el proporció la dilució final després de la dilució en sèrie. La relació total de dilució que s’obté multiplicant el factor de dilució per si mateix tantes vegades com hi ha dilucions. Matemàticament, la fórmula és la següent: Dt = D1 x D2 x D3 x ... x Dnamb Dt que representa el factor de dilució total i Dn, la relació de la dilució.- Per tant, suposem que realitza una dilució 1/10 d’un líquid 4 vegades seguides. A la fórmula, substituïu el factor de dilució pel seu valor: Dt = 10 x 10 x 10 x 10 = 10.000
- El factor de dilució final del quart tub de la vostra dilució en sèrie és d’1 / 10 000. La concentració de la solució de l’últim tub és ara 10 000 vegades inferior a la de la solució original.
-

Determineu la concentració d’una solució després de la dilució. Per trobar la concentració final d’una solució després de la dilució en sèrie, cal conèixer la concentració inicial. La fórmula és a continuació: Cfinal = Cinicial/ Aamb Cfinal que representa la concentració terminal de la solució diluïda, Cinicial, la concentració de la solució borsària i D, la relació de la dilució determinada amb antelació.- Aleshores, si dilueu una solució cel·lular amb una concentració de 1.000.000 cel·les per ml i el vostre percentatge de dilució es va establir en 1.000, quina serà la concentració final de la vostra mostra diluïda?
- Utilitzeu la fórmula:
- Cfinal = Cinicial/ A
- Cfinal = 1 000 000/1 000
- Cfinal = 1000 cel·les / ml
-

Fixeu-vos en les unitats que s’utilitzen. Quan feu els vostres càlculs, comproveu sempre que utilitzeu les mateixes unitats. Així, si parteix d’una concentració de cèl·lules per ml, el resultat final també serà en cèl·lules per ml. Si la concentració inicial és de parts per milió (ppm), la concentració final serà de parts per milió.

