Com es troba el nombre de protons, electrons i neutrons
Autora:
Roger Morrison
Data De La Creació:
27 Setembre 2021
Data D’Actualització:
1 Juliol 2024

Content
- etapes
- Primera part Calcula el nombre de protons, electrons i neutrons
- Part 2 Calcula el nombre d’electrons en un ió
Els neutrons, els electrons i els protons són les tres partícules principals que formen un àtom. Com podeu imaginar, els protons tenen una càrrega positiva, els electrons porten una càrrega negativa i els neutrons són només partícules neutres. La massa d’electrons és molt petita. Tot i això, neutrons i protons tenen masses similars. Per trobar el nombre de protons, electrons i neutrons d’un àtom, n’hi ha prou amb consultar la taula periòdica dels elements, també anomenada taula de Mendeleev.
etapes
Primera part Calcula el nombre de protons, electrons i neutrons
-
Obteniu una taula periòdica d’elements. Aquesta taula us ajudarà a trobar el nombre de protons, electrons i neutrons en un element. És una taula que presenta els elements segons la seva estructura atòmica. Un codi de colors distingeix els diferents elements. Cada element s’identifica amb un símbol que conté una, dues o tres lletres. La taula també mostra altra informació com la massa atòmica i el nombre atòmic de cada element.- Podeu trobar aquest gràfic o bé fent una cerca a Internet o en un llibre de química.
- En els exàmens, normalment se us permetrà utilitzar una taula periòdica d’elements.
-
Identifiqueu el vostre element a la taula periòdica. A la taula, els elements s’agrupen segons el seu nombre atòmic. Es divideixen en tres grups principals: metalls, no metàl·lics i metal·loides (semi-metalls). Altres grups inclouen metalls alcalins, halògens i gasos nobles.- És més fàcil localitzar un element de la matriu mitjançant el seu grup (columna) o període (fila).
- Si no coneixeu les propietats de l’element, podeu cercar el seu símbol.
-
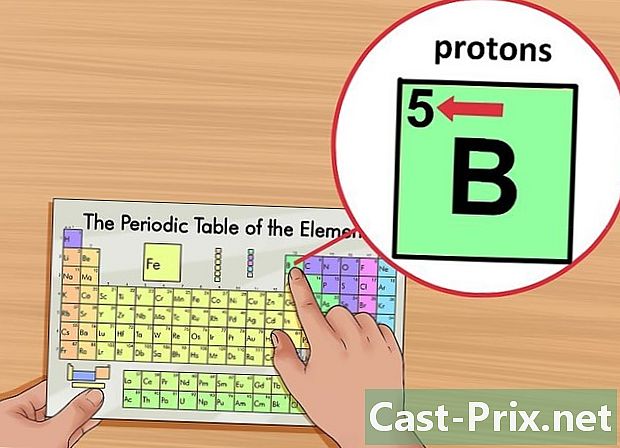
Localitza el nombre atòmic de l’element. Aquest número està marcat a la cantonada superior esquerra de la caixa, a sobre del símbol de l'element. El nombre atòmic proporciona el nombre de protons que componen l'element en qüestió.- Per exemple, el nombre atòmic de bor (B) és 5. Per tant, té 5 protons.
-

Determineu el nombre d’electrons. El nucli d’un àtom inclou protons que són partícules carregades positivament. Els electrons són partícules carregades negativament. Per tant, el nombre de protons i electrons d’un element neutre serà el mateix.- Per exemple, el bor (B) té un nombre atòmic de 5, de manera que té 5 protons i 5 electrons.
- Tanmateix, si es tracta d’un ió positiu o negatiu, el nombre de protons i el nombre d’electrons serà diferent. Haureu de calcular-les. La càrrega del lleó s'indica en lletra petita per un exponent després de l'element corresponent.
-

Busqueu la massa atòmica de l’element. Aquest pas us permetrà trobar el nombre de neutrons. Primer hauràs de determinar la massa atòmica o el pes atòmic de l’element. Aquesta dada representa la massa mitjana dels àtoms d’aquest element. Està inscrit sota el símbol de l’element.- Assegureu-vos d'arrodonir la massa atòmica de l'element al nombre sencer més proper. Així, el boro té una massa atòmica de 10.811, però haurà de rodar fins a 11.
-

Marca la diferència entre el nombre atòmic i la massa atòmica. Per calcular el nombre de neutrons, heu de diferenciar entre el nombre atòmic i la massa atòmica. No oblideu que ja coneixeu el nombre atòmic. Simplement és idèntic al dels protons.- Per al boro, tindreu: 11 (massa atòmica) - 5 (nombre atòmic) = 6 neutrons
Part 2 Calcula el nombre d’electrons en un ió
-

Trobeu la càrrega elèctrica d’un ió. Aquest número apareix per exponent després del símbol de l'element. Un ió és un àtom amb càrrega positiva o negativa a causa de l'addició o la supressió d'electrons. El nombre de protons en un àtom no varia. Tanmateix, en un ió, el nombre d’electrons es modifica.- Com que un electró té una càrrega negativa, es torna positiu després de l'eliminació d'un o més electrons. D’altra banda, l’addició d’electrons tindrà com a efecte que la càrrega sigui negativa.
- Per exemple, la càrrega de N és -3. En canvi, la de Ca és +2.
- No oblideu que aquest càlcul no és necessari, si el símbol de l’element no va seguit d’un exponent.
-

Retireu la càrrega del número atòmic. Originalment, un ió amb càrrega positiva és un àtom que ha perdut electrons. Per trobar el nombre d’electrons, heu de restar les càrregues addicionals al nombre atòmic. Si el lleó és positiu, el nombre de protons és major que el d’electrons.- Per exemple, la càrrega de Ca és +2. Com a resultat, va perdre 2 electrons en comparació amb el seu estat inicial. El nombre atòmic del calci és igual a 20, de manera que el lleó té 18 electrons.
-

Afegiu una càrrega al nombre atòmic d’ions negatius. Quan un ió es carrega negativament, el latome té electrons addicionals. Per calcular el nombre total d’electrons, n’hi ha prou amb afegir el nombre de càrregues addicionals al nombre atòmic. Si el lleó és negatiu, té menys protons que l'electró.- Per exemple, la càrrega de N és -3. Per tant, porta 3 electrons més en comparació amb el seu estat inicial. El nombre atòmic de lazote és de 7. Per tant, aquest ió té 10 electrons.